元素は物質の基本構成要素であり、1種類のみの元素からできている物質を単体(simple substance)といい、2種類以上の元素からできている物質を化合物(compound)という。各元素には基本最小粒子の原子がそれぞれ存在する。例えば、水素元素の原子は水素原子、酸素元素の原子は酸素原子という。原子は正の電荷をもつ原子核(nucleus)と負の電荷をもつ電子(electron)からできていて、原子核は正電荷を担う陽子(proton)と電荷をもたない中性子(neutron)からできている。元素の化学的性質は電子の状態によるが、それを決定しているのは陽子であり、各元素の性質は陽子数で決まる。この陽子の数を原子番号(atomic number)という。原子番号1の水素原子は陽子数が1である。電子の質量は陽子や中性子の約1840分の1で、原子全体の質量は陽子と中性子の数で決まる。陽子と中性子の数の和を質量数(mass number)といい、同じ元素の原子で中性子の数が異なるものを同位体(isotope)という。例えば、水素には三つの同位体があり、元素記号Hの左上に質量数を記してそれぞれ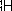 、
、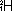 、
、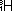 と区別する。左下には陽子数が示される。原子の相対質量(
と区別する。左下には陽子数が示される。原子の相対質量(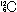 の質量を12とする)を原子量(atomic weight)という。ほぼ質量数に近い値だが、同位体が存在するので、その存在比の平均値である。一方で、原子量にg(グラム)をつけた質量は1mol(1molの物質に含まれる分子や原子の量はアボガドロ定数〈Avogadro's constant〉個≒6.02×1023個)の原子の質量である。
の質量を12とする)を原子量(atomic weight)という。ほぼ質量数に近い値だが、同位体が存在するので、その存在比の平均値である。一方で、原子量にg(グラム)をつけた質量は1mol(1molの物質に含まれる分子や原子の量はアボガドロ定数〈Avogadro's constant〉個≒6.02×1023個)の原子の質量である。
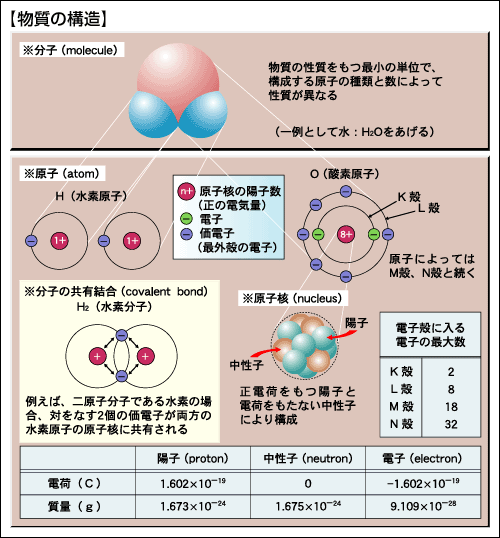
図「物質の構造」