可逆反応(reversible reaction)、つまり反応物から生成物が生じる正反応(forward reaction)と、その逆の逆反応(reverse reaction)が同時に起こるような反応がある程度進み、反応物と生成物の比が一定となり、見かけ上は反応が進まない状態(→「化学式」)。このとき、正反応の速度と逆反応の速度は等しい。以下の反応
H2+I2 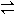 2HI
2HI
が平衡常態にあれば、一定温度では反応物と生成物の濃度比
[HI]2/([H2][I2])=K
は一定となる。このKを平衡定数(equilibrium constant)というが、反応物の濃度で表されているので濃度平衡定数(concentration equilibrium constant)ともいう。気体反応の場合、気体の分圧の比から得られるものは圧平衡定数(pressure equilibrium constant)という。平衡状態にある化学反応の条件(温度、濃度、圧力など)を変化させると、その変化が引き起こす影響を打ち消すように平衡が移動する。これをルシャトリエの原理(Le Chatelier’s principle)という。ハーバーとボッシュはアンモニアの工業的合成
N2+3H3 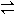 2NH3
2NH3
にこの原理を適用して成功した。
また、電解質が水溶液中でイオンに分かれる電離平衡(electrolytic dissociation equilibrium)、たとえば
CH3COOH 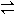 CH3COO-+H+
CH3COO-+H+
は、水溶液のさまざまな性質を決める重要な平衡である。